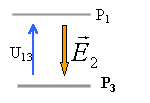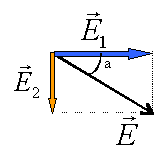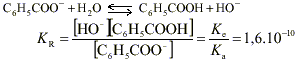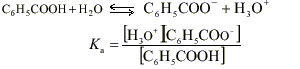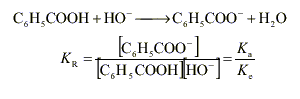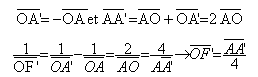You can do and give any exersices in this website.
thank and goob luck !
exercices de physiques et de chimie
|
Le montage représenté ci-dessous permet l’étude de l’établissement du courant dans un circuit comportant une bobine d’inductance L et de résistance r et une résistance R. 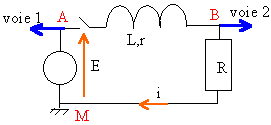
Données :U=E= 3,8 V ; R=50 ohms. Un ordinateur muni d’une carte d’acquisition permet d’enregistrer l’évolution des tensions U aux bornes du générateur et uR aux bornes de la résistance R. À t=0 l’interrupteur est fermé et l’acquisition commence. Le document (A) ci-après représente le graphe de ces tensions en fonction du temps. 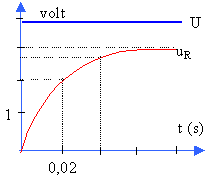
corrigé
|
|||||||||||||||||||||
|
|
En régime permanent, la bobine alimentée par un générateur de tension constante se comporte comme une résistance de valeur r et uR= 3 V d'où I=3 /50 = 0,06 A. Aux bornes de dipoles en série les tensions s'ajoutent et leur somme est égale à E E = Ri + ri +L di/dt (1). Lorsque le régime permanent est établi , di / dt =0 et E=(R+r) I R+ r = 3,8 /0,06 = 63,3 W soit r = 13,3 W. Le produit kt est sans dimensions ; k s'exprime en s-1 , inverse d'un temps.
t = 1 / 59,585 = 0,0168 s t = L / (R+r ) d'où L= 0,0168*63,3 = 1,06 H
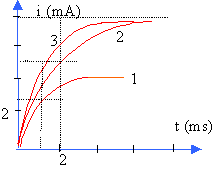
étude de la courbe 1
I voisin 4 mA; à t = t , l'intensité est égale à : 4*0,63 = 2,5 mA lecture graphique t voisin de 1 ms = 10-3 s. L = Rt =1000 *0,001 =1 H étude de la courbe 2 I voisin 8 mA (même valeur pour la courbe 3) donc R = 3,8 / 0,008 voisin 475 W. à t = t , l'intensité est égale à : 8*0,63 = 5 mA lecture graphique t voisin de 2 ms = 2 10-3 s. L = Rt =500 *0,002 =1 H étude de la courbe 3 I voisin 8 mA donc R = 3,8 / 0,008 voisin 475 W. à t = t , l'intensité est égale à : 8*0,63 = 5 mA lecture graphique t voisin de 1 ms = 10-3 s. L = Rt ; 1 = 500 *0,001 soit L= 0,5 H.
|
|
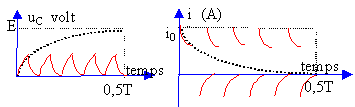
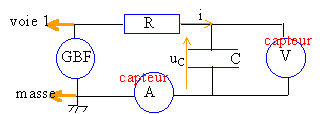
On considére un circuit série comprenant un générateur basse fréquence GBF, un résistor R et un condensateur de capacité C. La tension aux bornes du GBF est visualisée à l'oscilloscope. 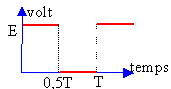 Les capteurs EXAO, voltmètre et ampéremètre permettent de visualiser sur l'écran de l'ordinateur les courbes suvantes. 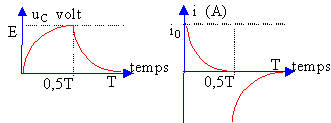
corrigé
|
|
|
|
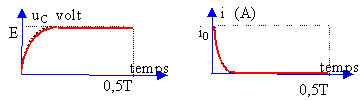
Le régime transitoire correspond à la charge du condensateur : la tenson aux bornes du condensateur croît de 0 à E volt. L'intensité décroît de i0 à 0 A. En régime permanent le condensateur est chargé : la tension à ces bornes vaut E. L'intensité initiale du courant est : i0= E/R ( au départ le condensateur étant déchargé, la tension à ces bornes vaut O volt). Le produit RC est la constante de temps du dipole RC. Le condensateur est chargé au dela d'une durée supérieure à 5 fois cette constante de temps. RC s'exprime en seconde. analyse dimensionnelle R : [W] ou [V] [A]-1. C : [coulomb] [V]-1=[A] [s] [V]-1 RC : [V] [A]-1[A] [s] [V]-1= [s] RC est inchangé, donc la durée nécessaire à la charge reste inchangée.
La période du GBF est 10 fois plus petite (fréquence 10 fois plus grande), le condensateur n'aura pas le temps de se charger complétement.
A fréquence élevée, le condensateur n'a pas le temps de se charger et la tension à ces bornes reste pratiquement nulle. Il se comporte comme un simple petit fil de cuivre. L'intensité du courant reste voisine de i0 =E/R. La période du GBF est 10 fois plus grande (fréquence 10 fois plus petite), le condensateur a le temps de se charger complétement. La tension à ces bornes vaut E et l'intensité du courant tend vers zéro.
A basse fréquence, le condensateur a le temps de se charger et la tension à ces bornes reste égale à E. Il se comporte comme une résistance infinie. L'intensité du courant tend rapidement vers zéro.
|
|
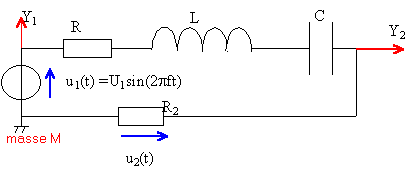
On branche en série une pile de fem E et de résistance interne r, un interrupteur K, une bobine inductive d'inductance L et de résistance R1, et un résistor R2. 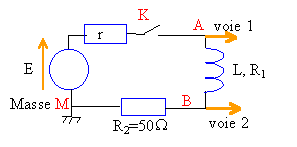 Un ordinateur relié au montage par une interface appropriée, permet d'enregistrer au cours du temps les valeurs des tensions.
corrigé
|
|
|
|
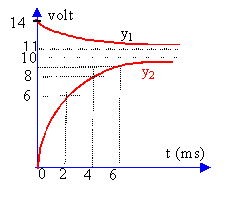
Sur la voie 1 on visualise uAM, tension aux bornes de la pile, générateur de tension imparfait. y1 correspond à uAM. A l'instant où l'on ferme le circuit, l'intensité est nulle et la tension aux bornes de la pile est égale à sa fem soit E=14 V (lecture graphe y1). Sur la voie 2 on visualise la tension uBM, aux bornes d'un résistor. A l'instant où l'on ferme le circuit, l'intensité est nulle et la tension aux bornes du résistor R2 est nulle. y2 correspond à uBM. La bobine stocke de l'énergie lors de la fermeture de l'interrupteur ce qui a pour conséquence de retarder l'établissement d'un régime permanent (intensité constante dans ce cas). en régime permanent :
Y = 9,5 V lecture graphe y2. 9,5 = 50 I d'où I = 0,19 A. uBM = 50 I =Y =9,5 V La bobine se comporte comme une résistance uAB = R1 I = 0,19 R1. si R1 voisin de zéro alors uAM voisin de uBM. Or la lecture des graphes pour un temps supérieur à 10 ms montre une différence entre uAM et uBM. Cette différence représente uAB tension aux bornes de la bobine en régime permanent. uAB voisin de 2V (lecture graphe) d'où R1 voisin de 2 /0,19 = 10,5 W. uAM = E-rI =14-0,19 r voisin de 11,5 V (lecture graphe à t supérieur à 10 ms) 0,19 r = 2,5 d'où r = 13,1 W. équation aux dimensions
L : [H] = [V] [A] -1 [s]. remarque u=Ldi / dt aux bornes bobine pure. R :[W]= [V] [A]-1. L / R : [V] [A] -1 [s] [A] [V]-1 = [s] R représente la somme de toutes les résistances du circuit soit R = r +R1 + R2 = 73,6 W. intensité Lorsque le temps devient grand (supérieur à 5 fois la constante de temps) l'exponentielle tend vers zéro et A représente l'intensité en régime permanent soit I=0,19 A. constante de temps détermination graphique y2. L'intensité est constante à partir d'une durée voisine de 5t soit environ 10ms d'où t voisin 2 ms. La valeur de l'intensité est égale à 0,63 I à un temps égal à t. soit uBM voisin de 0,63*9,5 = 6V d'où t voisin 2 ms. le coefficient directeur de la tangente à la courbe y2 à t=0 est égal à R2I / t = 9,5 / t. inductance et énergie stockée : L = R t =73,6* 2 10-3 = 0,15 H. énergie : 0,5 L I² = 0,5 *0,15*0,19² = 2,7 mJ. |
résonance d'intensité facteurs influançant la résonance |
Au cours d'une séance de travaux pratiques, un élève souhaite déterminer l'influence des paramètres R, L et C sur le phénomène de résonance en intensité. Pour cela, il dispose du matériel suivant :
Fréquence de résonance. L'élève réalise un montage en série avec la bobine, le conducteur ohmique, le condensateur et le GBF.
Les résultats sont-ils concordants avec la méthode utilisée à la question 2. ? 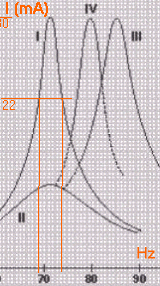
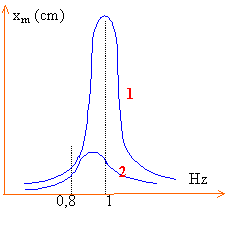
Influence des paramètres R, L et C sur la fréquence de résonance. En comparant les courbes de résonance données ci dessus, on veut alors étudier qualitativement l'influence : - de la résistance totale du circuit (courbes I et II) ; - de l'inductance de la bobine (courbes I et III) ; - de la capacité du condensateur (courbes I et IV).
Etude de l'influence de la résistance. Déterminer la fréquence de résonance sur la courbe (II) qui correspond à R = R+ R2 = 100 W Que peut-on dire de l'influence de la valeur de la résistance du circuit sur la fréquence de résonance ? Etude de l'influence de l'inductance. Déterminer la fréquence de résonance sur la courbe (III) qui correspond à L = 0,7 H , les autres paramètres n'étant pas changés. En déduire, sans calcul, l'influence de L sur la fréquence de résonance. Etude de l'influence de la capacité. Déterminer la fréquence de résonance sur la courbe (IV) qui correspond à C = 4,0 mF , les autres paramètres n'étant pas changés. En déduire, sans calcul, l'influence de C sur la fréquence de résonance. Influence des paramètres R, L et C sur Df , largeur de la bande passante à 3 dB.
corrigé
|
|
|
|
A la résonance l'intensité passe par une valeur maximale, en conséquence la tension aux bornes du résistor R2 passe par une valeur maximale. calcul de f0 : 1/ (2p racine carrée (LC))= 1/(6,28 racine carrée (1*5 10-6 )) =71,2 Hz cette valeur correspond à la valeur expérimentale La résistance à peu d'influence sur la fréquence de résonance (graphes I et II). Par contre la résistance influe sur l'acuité de la résonance (si R augmente, la résonance devient floue). courbe III : f0 voisin de de 87 Hz. Lorsque l'inductance diminue, la fréquence de résonance augmente courbe IV : f0 voisin de de 80 Hz. Lorsque la capacité diminue, la fréquence de résonance augmente bande passante :
ensemble des fréquences telles que l'intensité soit supérieure à 0,707 fois la valeur de l'intensité à la résonance d'intensité. Multiplier l'intensité maximale 30 mA par 0,707 soit 21,2 mA tracer une horizontale passant par 22,1 mA puis deux verticales à partir des intersections courbe I -droite horizontale passant par 22,1 mA la distance de ces 2 droites verticales donne la bande passante (voisine de 5 Hz). intervalle de fréquences [69 Hz; 74 Hz] courbes I et II: la somme des résistances est triplée (courbe II) par rapport à la courbe I. On constate que Df2 v isin de 3 fois Df1. Ce résultat est compatible avec la relation proposée. courbes I et III: l'inductance est multipliée par 0,7 (courbe III) par rapport à la courbe I. On constate que Df3 voisin de Df1divisé par 0,7 Ce résultat est compatible avec la relation proposée.
|
|
oscillateur élastique vertical : détermination de sa fréquence propre. L'oscillateur est constitué d'un ressort vertical de masse négligeable, de constante de raideur k, de longueur à vide 0,1 m auquel est suspendu un solide de masse 50 g.
oscillateur élastique soumis à une excitation sinusoïdale. 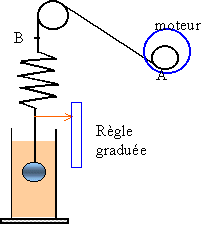 La vitesse de rotation du moteur est réglable. Larbre est muni d'un exentrique A. Le point A décrit un cercle de rayon A. Le point B est animé d'un mouvement sinusoïdal d'amplitude a. La fréquence du point B est proportionnelle à la vitesse angulaire du moteur. Le moteur constitue l'excitateur et le pendule vertical est le résonateur. Moteur arrèté, on détermine la fréquence propre du résonateur élastique non amorti en mesurant 10 périodes. On trouve f0 = 1Hz. L'éprouvette contenant de l'eau a été retirée pour cette mesure. Moteur lancé: l'amplitude xm des oscillations du résonateur dépend de la fréquence de l'excitateur. On effectue deux séries de mesures: cas 1 , cylindre non immergé et cas 2, cylindre immergé.
On considère l'association série, conducteur ohmique R2=400W, bobine L=0,1H, R=50W et condensateur C=0,1 mF. Aux bornes du dipôle on place un GBF qui impose une tension sinusoïdale telle que : u(t) =Um sin (2pft) = Um sin (wt). On dispose d'un oscilloscope bicourbe et de 2 multimètres à affichage numérique.
corrigé
|
|
|
|
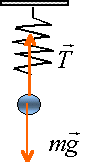
A l'équilibre le poids est opposé à la tension et la tension est proportionnelle à l'allongement du ressort. mg=k(L-L0) masse en kg; L-L0 en mètre k = 0,05*9,8 / (0,12-0,1)= 24,5 Nm-1. oscillations libres non amorties (pas de frottements) période : T=2p racine carrée (m/k) T=2*3,14 racine carrée (0,05/24,5) =0,2837 s fréquence = 1 / 0,2837 =3,52 Hz.
cas 1 : oscillations forcées avec un amortissement faible
la résonance est aigue, pic étroit f0 = 1 Hz cas 2 : oscillations forcées avec un amortissement important résonance floue, abscence de pic aigu. f0 = 0,9 Hz 
La tension aux bornes du résistor R2 est proportionnelle à l'intensité. Observer la tension aux bornes de R2, c'est observer l'image de l'intensité au facteur R2 près. A la résonance d'intensité, la tension aux bornes du dipole et l'intensité qui le traverse sont en phase. La période est voisine de 2 ms et la fréquence voisine de 1/ 0,002 = 500 Hz. Um = 4 volts et R2Im = 400 Im =3,5 volts Im = 3,5 / 400 = 8,75 mA. impédance Z = Um / Im = 3,5 /0,00875 = 400 W. A la résonance d'intensité, l'impédance du dipole RLC est minimale, égale à la somme des résistance du circuit soit 400+50 =450 W. |
interfrange, trou d'Young, analyse dimensionnelle |
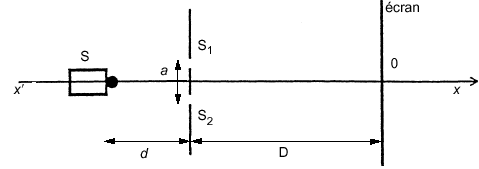
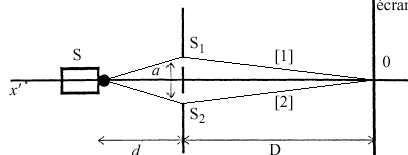
Le dispositif comprend une plaque percée de deux trous de Young distants de a =500 µ m. En utilisant comme source émettrice S un laser He-Ne, de longueur d’onde l= 633 nm on produit des interférences sur un écran. La plaque est placée à une distance d =20 cm de la source, l’écran à une distance D = 4 mde la plaque. Les deux trous de même diamètre sont placés à égale distance de la source et se comportent comme deux sources synchrones et cohérentes.
corrigé
|
|
|
|
écran où se superposent les 2 faisceaux lumineux issus des 2 sources secondaires S1 et S2. Ces 2 faisceaux lumineux issus d ’une même source ponctuelle S sont cohérents. interférences constructives et sur l ’écran, on a une raie brillante. Si les 2 vibrations qui interfèrent sont en phase, l’amplitude de la vibration est maximale. interférences destructives et sur l ’écran, on a une raie sombre. Si les 2 vibrations qui interfèrent sont en opposition de phase, l’amplitude de la vibration est nulle. Pour atteindre le point O, les vibrations lumineuses parcourent la même distance qu'elle prenne le chemin [1 ] ou le chemin [2 ]. La différence de marche est nulle.
Les 2 vibrations qui interfèrent en O sont alors en phase : frange brillante et interférences constructives.
analyse dimensionnelle : l, D, a, d et i sont des longueurs :[L] (a) lD/a expression possible car [L] [L] [L]-1 = [L] (b) lD² expression impossible car [L] [L] [L] = [L]3 (c) Da / l expression possible car [L] [L] [L]-1 = [L] (d) la/D expression possible car [L] [L] [L]-1 = [L] (e) ld/a expression possible car [L] [L] [L]-1 = [L] recherche de la bonne expression de l'interfrange : lvert < lrouge et l'interfrange i diminue: i et l varie donc dans le même sens. (c) Da / l éliminé. D augmente, alors l'interfrange i augmente: D et i varie dans le même sens. (d) la/D éliminé la position de S sur l'axe xx' ne modifie pas l'interfrange: i indépendant de d (e) ld/a éliminé la distance S1S2 = a et l'interfrange i varie en sens contraire (a) lD/a expression correcte. calcul de l'interfrange : l = 633 nm = 6,33 10-7 m D= 4 m; a = 5 10-4 m i = 6,33 10-7 *4 /5 10-4 = 5,06 mm. |
|
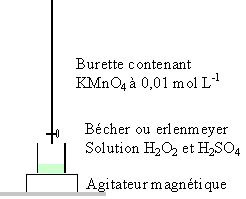
L’eau oxygénée ou solution aqueuse de peroxyde d’hydrogène H2O2 est une espèce oxydante utilisée au laboratoire. Il s’agit aussi d’une espèce chimique utilisée dans la vie courante : décoloration des cheveux, désinfection des verres de contact, désinfection des plaies. Sa décomposition, qui produit un dégagement de dioxygène, est accélérée par certains facteurs comme l’exposition à la lumière, l’ion fer (II), l’ion fer (III), le platine… On se propose d’étudier la cinétique de la réaction de décomposition du peroxyde d’hydrogène réalisée en présence de l’ion fer (II). L’équation-bilan de cette réaction est : 2 H2O2.donne O2 + 2 H2O réaction (1) On réalise le protocole expérimental suivant : •On prépare huit bechers contenant chacun V0 = 10,0 mL d’une solution aqueuse de peroxyde d’hydrogène de concentration [H2O2]0 = 5,8 × 10 -2 mol.L -1 . •On les place dans une enceinte thermostatée qui maintient la température à la valeur . t1 = 20 °C. •À la date to = 0 s, on ajoute dans chaque becher quelques gouttes d’une solution contenant des ions fer (II). Il se produit alors la réaction (1). •À la date t, on prend un des huit bechers. On ajoute une grande quantité d’eau glacée dans celui-ci. On acidifie le contenu de ce becher en ajoutant quelques gouttes d’acide sulfurique concentré. •À l’aide d’une solution aqueuse de permanganate de potassium fraîchement préparée, de concentration C = 1,0 × 10 -2 mol.L -1 , on dose le peroxyde d’hydrogène restant dans le becher. On note V le volume versé de solution aqueuse de permanganate de potassium pour obtenir l’équivalence d’oxydoréduction. L’équation-bilan de la réaction de dosage est : 2 MnO4 - + 5 H2O2 + 6 H3O +donne.2 Mn 2+ + 5O2 + 14 H2O réaction (2)
À propos du protocole
Préparation préalable de la solution de permanganate de potassium Un élève doit préparer 200,0 mL de solution aqueuse de permanganate de potassium de concentration C = 0,01 mol.L -1 à partir d’une solution (notée S) de permanganate de potassium de concentration CS = 0,1 mol.L -1 .Pour réaliser cette opération, il prélève 10,0 mL de solution S contenue dans un verre à pied, à l’aide d’une pipette jaugée. Il verse le prélèvement dans un becher et complète avec de l’eau distillée jusqu’à la graduation 200 mL. Cet élève a commis deux erreurs. Lesquelles ? Comment les corriger ? Étude de la réaction de décomposition de l’eau oxygénée à la température t1 = 20°C 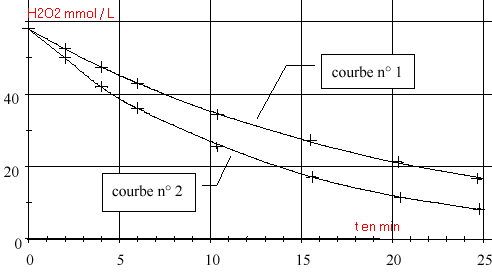 On a représenté la concentration en peroxyde d’hydrogène restant en fonction du temps (courbe 1) . On mesure la vitesse instantanée volumique aux instants t = 12 min et t' = 20 min. On trouve 1,1 mmol L-1 min-1 et 1,6 mmol L-1 min-1 .
Étude de la réaction de décomposition de l’eau oxygénée à la température de 40 °C On recommence les mêmes expériences que précédemment mais l’enceinte thermostatée est maintenue à la température t2 = 40 °C. On obtient la courbe 2 (voir graphe).
Expression de la concentration en [H2O2] restant en fonction du temps Pour tracer les courbes 1 et 2, on a dû calculer la concentration [H2O2] en peroxyde d’hydrogène restant à chaque instant de date t. Établir l’expression de la concentration [H2O2] en peroxyde d’hydrogène restant à une date t en fonction de C concentration de KMnO4 ,V et V0. corrigé
|
|||||||||||
|
|
10 mL d'eau oxygénée sont prélevés à l'aide d'une pipette jaugée surmontée d'un pipeteur La température est un facteur cinétique : la vitesse d'une réaction croît avec la température. l'eau glacée provoque un blocage cinétique de la réaction (1) de décomposition de l'eau oxygénée.
Le permanganate de potassium joue un double rôle, celui de réactif et celui d'indicateur coloré, MnO4- étant le seul ion très coloré (violet foncé) erreur commise : il faut utiliser une fiole jaugée de 200 mL afin que la mesure du volume 200 mL soit précise. Ne pas utiliser de bécher, ce serait trop imprécis.
La fiole jaugée doit contenir un peu d'eau distilée, ajouter ensuite les 20 mL prélevés et non pas 10 mL. diluer 10 fois c'est prélever 20 mL de solution mère pour un volume final de 200 mL Le verre à pied sera remplacé par un bécher ou un erlenmeyer.(plus grande stabilité) une vitesse de réaction est toujours positive
vitesse de disparition de l'eau oxygénée = - variation de la quantité (négative dans ce cas) de matière d'eau oxygénée divisée par la durée de cette variation. Sur le graphique cette vitesse correspond à la valeur absolue du coefficient directeur de la tangente à la courbe au point considéré. La vitesse étant proportionnelle à la quantité de matière d'un réactif, elle diminue lorsque la quantité de matière d'eau oxygénée diminue La plus grande valeur correspond à 12 minutes. temps de demi réaction : lecture graphe (1)
Quantité initiale d'eau oxygénée initiale voisine 58 mmol L-1. diviser par 2 soit 29 mmol L-1. tracer une horizontale passant par 29 mmol/L puis une verticale à partir de l'intresection avec la courbe (1). On lit t1 voisin de 13 min. même méthode avec la courbe (2) . On trouve t2 voisn de 8 min interprétation : la vitesse d'une réaction augmente lorsque la température augmente. au départ : 5,8 10-2 V0 mol H2O2.
à l'équivalence du dosage redox : CV mol permanganate et V0[H2O2] mol d'eau oxygénée restant en solution
2V0[H2O2] =5 CV [H2O2] = 2,5 CV / V0
|
courbes catalyseur autocatalyse |
Trois expériences sont réalisées à température et volume constants afin d'étudier l'évolution de trois " systèmes chimiques " au cours du temps. A l'instant t = 0 on mélange les réactifs 1 et 2 suivants : Expérience I 0,50 mol de propanoate d'éthyle 0,50 mol d'eau Expérience II 10 mL d'une solution aqueuse de peroxyde d'hydrogène (ou eau oxygénée) de concentration 1,0 mol/L 50 mL d'une solution aqueuse contenant 0,8mol/L d'ions tartrate en milieu acide à chaud Expérience III 10 mL d'une solution aqueuse de permanganate de potassium de concentration 2,0.10-2 mol/L 30 mL d'une solution aqueuse de peroxyde d'hydrogène de concentration 0,1 mol/L en milieu acide Données :Le rendement d'une réaction d'estérification ou d'hydrolyse est le rapport entre la quantité de produit formé et celle qui aurait été obtenue si la réaction avait été totale.Le rendement d'une estérification, dans le cas d'un mélange équimolaire (avec un alcool primaire ) est égal à 67 %. Le rendement d'une hydrolyse, dans le cas d'un mélange équimolaire ( produisant un alcool primaire)est égal à 33%. Dans le cadre de l'expérience II le potentiel rédox des couples est dans l'ordre décroissant représenté ci-dessous : eau oxygénée / eau ; ion cobalt III / ion cobalt II ; dioxyde de carbone / ion tartrate. En solution aqueuse, les ions permanganate sont violet, les ions cobalt (III) sont verts, les ions cobalt(II) sont roses, toutes les autres entités sont incolores. 1 - Expériences I Pour la réaction I:
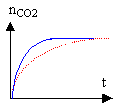
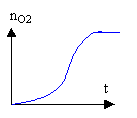
2 - Expérience II L'équation-bilan de la réaction II est la suivante : 5 H2O2 + C4H4O62- + 2 H+ donne 8 H2O + 4 CO2(gaz) a) On prépare un mélange témoin de solution aqueuse de peroxyde d'hydrogène et de solution contenant les ions tartrate en milieu acide à chaud : on observe au bout d'un temps assez long un très léger dégagement gazeux. L'ajout de cristaux de chlorure de cobalt (II) dans un mélange identique au mélange témoin se colore tout d'abord en rose, puis rapidement un dégagement gazeux devient très important et la solution devient verdâtre. Après quelques instants, le dégagement gazeux diminue et la solution reprend la couleur rose. Quel est le rôle joué par les ions Co2+ ? Interpréter les changements de couleurs observés. (Aucune équation-bilan n'est demandée.) b) On a tracé le graphique représentant l'évolution de la quantité nCO2 de dioxyde de carbone formé au cours du temps, sans ajout d'ions Co2+ : on a obtenu le graphique ci dessous. On ajoute des ions Co2+ au mélange réactionnel : reproduire le graphique sur la copie et indiquer sur celui-ci, comment il est éventuellement modifié. 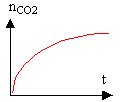 3 Expérience III L'équation bilan de la réaction III est la suivante : 2 MnO4- + 5 H2O2 + 6 H+ donne 2 Mn2+ + 5 O2(gaz) + 8 H2O Cette réaction entre les ions permanganate et l'eau oxygénée a pour catalyseur les ions Mn2+. a) On a tracé le graphique ci-dessous représentant l'évolution de la quantité de dioxygène nO2 formé au cours du temps. Décrire l'évolution de la vitesse de formation du dioxygène au cours du temps et justifier cette évolution. b) Donner la valeur numérique finale de la quantité de dioxygène nO2 formé.
corrigé
|
||||||||||||||||
|
|
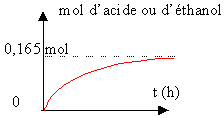
CH3-CH2-COO-CH2-CH3 + H2O équilibre avec CH3-CH2-COOH + CH3-CH2OH réaction lente, limitée par l'estérification, athermique.
0,5 * 0,33 = 0,165 mol d'acide ou d'éthanol lorsque l'équilibre est atteint. Les ions cobalt II joue le rôle de catalyseur : ils accélèrent la réaction mais n'interviennent pas dans le bilan final. Le potentiel redox du couple Co3+/Co2+ est intermédiaire entre les potentiels redox des couples faisant intervenir l'eau oxygénée et les ions tartrates.
Le catalyseur intervient en remplaçant une réaction lente par deux réactions plus rapides. Puis il est régénéré en fin de réaction. ( d'où le passage par la couleur verte des ions Co3+ en cours de réaction)
courbe bleue (présence du catalyseur) et pointillé rouge sans catalyseur. réaction autocatalysée :
la vitesse correspond au coefficient directeur (en valeur absolue) de la tangente à la courbe. facteur n°1 : la vitesse est d'autant plus importante que la quantité de catalyseur est grande: celle ci est nulle au départ puis croît au cours du temps. facteur n°2 : la vitesse est d'autant plus grande que la quantité de matière des réactifs est grande : celle ci est importante au départ puis décroît au cours du temps. Au début, le facteur n°1 l'emporte et la vitesse est faible, mais va croître rapidement dès que la quantité de catalyseur sera grande. vers la fin c'est le facteur n°2 qui l'emporte et la vitesse diminue jusqu'à s'annuler.
|
|
Les lentilles de contact souples doivent être retirées quotidiennement. Leur entretien se fait en deux étapes : une décontamination par une solution de peroxyde d'hydrogène(ou eau oxygénée) pour éliminer les germes pathogènes, suivie de la décomposition du peroxyde d'hydrogène pour que la lentille puisse être remise, sans danger, au contact de l'œil. On se propose d'étudier, en présence d'un catalyseur, la cinétique de la décomposition du peroxyde d'hydrogène contenu dans une solution utilisée pour la décontamination des lentilles de contact. Données : Etiquettes de la solution commerciale de décontamination :- peroxyde d'hydrogène stabilisé : 3,10 g ;- eau purifiée ajoutée pour arriver à un volume total de solution de 100 mL. Masses molaires atomiques : H = 1,0 ; O=16 g.mol-1. Volume molaire des gaz dans les conditions de l'expérience :Vm = 24 L.mol-1. Préparation de la solution S :
Présentation des catalyseurs utilisés pour la décomposition du peroxyde d'hydrogène : On utilise parallèlement deux catalyseurs :- le platine solide, déposé sous forme de poudre sur un support de plastique ;- une enzyme, la catalase, soluble en solution aqueuse.
Etude cinétique de la réaction. L'étude est menée à la température ambiante. A l'instant t = 0, on introduit : - le platine dans un échantillon de solution S, noté 1 ; - la catalase dans un échantillon de solution S, noté 2. Les volumes des deux échantillons sont égaux à Vs = 50 mL. Dans chaque échantillon, le peroxyde d'hydrogènese décompose en eau et en dioxygène suivant l'équation-bilan : On détermine à divers instant le volume de dioxygène dégagé et on en déduit la concentration en peroxyde d'hydrogène restant. On trace la courbe donnant la concentration en peroxyde d'hydrogène restant en fonction du temps, [H2O2]=f(t) 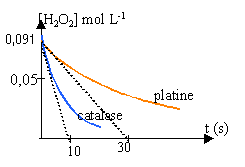
corrigé
|
||||||||||
|
|
la solution commerciale est diluée 10 fois donc prélever 20 mL de la solution du commerce à la pipette et placer dans une fiole jaugée de 200 mL catalyseur: augmente la vitesse d'une réaction mais il n'apparaît pas dans
le bilan. Le platine solide plonge dans un liquide donc catalyse hétérogène.
Quantité de matière d'eau oxygénée restant à la date t : 4,55 -x= 4,55- V / 12 concentration de H2O2 à la date t : (4,55- V / 12) /50 = 0,091 - V/600 avec V en mL (O2 dégagé) (1) vitesse de disparition de l'eau oxygénée à la date t = - variation de la concentration H2O2 / durée de la variation
Une vitesse étant toujours positive, on introduit un signe moins car la variation de la concentration d'un réactif est négative. Expérimentalement on mesure le volume de dioxygène dégagé et on utilise la formule (1) ci dessus. tracer la tangente à la date t aux courbes données, puis chercher le coefficient directeur de ces tangentes vitesses initiales de décomposition de l'eau oxygénée 0,091 / 10 = 0,0091 mol L-1 s-1. (catalase) 0,091 / 30 = 0,003 mol L-1 s-1. (platine) La concentration d'un réactif diminue au cours du temps; en conséquence la vitesse diminue au cours du temps. temps de demi réaction :
durée au bout de laquelle la moitié de la quantité de matière du réactif limitant a disparu. (lecture graphique en traçant une horizontale passant par 0,045) catalase : t1/2 voisin de 8 s platine : t1/2 voisin de 25 s la catalase permet une décontamination beaucoup plus rapide que le platine.
|
|
Pour une température de 25 °C et sous une pression de 1 bar, le phénol est un solide faiblement soluble dans l'eau. Il est irritant pour la peau. Sa formule est C6H5OH. Sa masse molaire moléculaire est : M = 94 g . mol -1 .En solution aqueuse, le phénol est un monoacide faible dont la base conjuguée est l'ion phénolate de formule C6H5O - .On se propose de déterminer expérimentalement, à 25 °C, la solubilité du phénol dans l'eau c'est-à-dire la masse maximale de phénol dissoute dans un litre de solution aqueuse. Dans tout l'exercice les solutions étudiées sont à 25 °C.
Réaction du dosage.
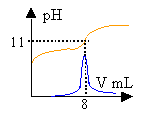 Exploitation du dosage.
corrigé
|
|||||||||||||||||||||
|
|
La solubilité du phénol à 25 ° est inférieure à 10 g/L. prélever environ 100 mL d'eau à l'aide d'une éprouvette graduée de 100 mL . pipette et burette sont utilisés pour prélever un volume précis; avec le bécher cela serait trop imprécis. La solution de soude est assez concentrée: prendre des gants (éviter le contact avec la peau) et mettre des lunettes de protection. C6H5OH + HO- donne C6H5O- + H2O.
H2O / HO- : pKa1 = 14 C6H5OH / C6H5O - pKa1 = 9,9 réaction entre la base la plus forte et l'acide le plus fort et la différence des pka est 4,1. constante de la réaction Kr=104,1 =12600, réaction totale. Donc elle peut servir de support à un dosage. A l'équivalence acido basique les quantités de réactifs sont dans les proportions stoéchiomètriques.
CaVa = Cb Vb A l'équivalence la courbe dpH/dV passe par un maximum. Ve=8 mL Ca=1*8 /10=0,8 mol L-1. soit 0,8*94=75,2 g /L. La zone de virage de l'indicateur coloré contient bien le pH à l'équivalence mais la variation de pH au voisinage de l'équivalence n'est pas très importante. En utilisant un indicateur coloré, la détermination de Ve est imprécise dans ce cas. Les concentrations des réactifs sont divisées par le même nombre.
A l'équivalence on a CaVa=CbVb donc le volume de soude Vb reste inchangé. Avec ces solutions diluées il n'y a pas de saut de pH à l'équivalence. Alors qu'avec la solution concentrée on observait un saut relativement important.
|
||||||||||||||||||||
champ magnétique
|
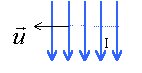
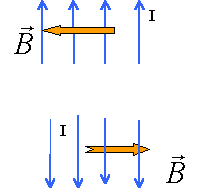
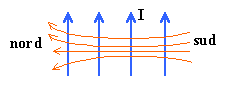
Soit un solénoïde de longueur L, comprenant N= 50 spires. Le diamètre du solénoïde est suffisamment petit devant sa longueur pour qu'on puisse le considérer comme infiniment long. Le solénoïde est parcouru par un courant I= 2,5 A dans le sens indiqué sur le schéma. perméabilité magnétique du vide m0=4p 10-7 SI Répondre par vrai ou faux en justifiant .
corrigé Le sens du champ magnétique dépend du sens du courant : règle de l'observateur d'Ampère : L'observateur est allongé sur le fil , le courant entre par les pieds; il regarde vers l'intérieur de la bobine; son bras gauche tendu indique le sens du champ.
n=50/0,5 = 100 spires par mètre B = 4*3,14 *10-7*100 * 2,5 = 3,14 10-4 T
En conséquence le champ ne change pas
Les lignes de champ sont parallèles à l'intérieur de la bobine longue sauf aux extrémités. Si on divise la longueur par deux on divise aussi le nombre de spires par deux et n ne change pas (toujours 100 spires par mètre). Le champ (Tesla) est uniforme à l'intérieur du solénoïde (sauf aux extrémités), proportionnelle à l'intensité du courant I( A) et au nombre de spires par mètre noté n. |
|
|
|
champ électrique dans une cage |
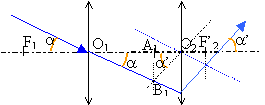
Quatre plaques métalliques P1, P2, P3, P4 forment sans se toucher une cage rectangulaire parallélépipédique.On appelle O le centre de symétrie de l'ensemble auquel on associe le repère (Ox,Oy) . La distance qui sépare P1 et P3 ou P2 et P4 est d=2,5 cm.
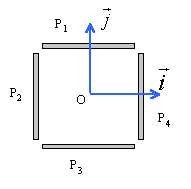
corrigé |
|
|
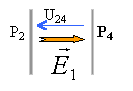
norme de E1 égale U24 divisée distance des plaques en mètres 150 / 0,025 = 6 000 V m-1.
norme de E2 égale U13 divisée distance des plaques en mètres 100 / 0,025 = 4 000 V m-1.
E²=E1²+E2² soit E= 7200 V m-1. tan a= 4000 / 6000 = 0,666 et a = 33,7 °
|
cinétique |
Le pentaoxyde de diazote N2O5 se décompose par chauffage selon la réaction d'équation bilan : 2 N2O5 --> 4 NO2 + O2. Un récipient initialement vide de volume 12 L est rempli avec du pentaoxyde de diazote à 20 ° jusqu'a ce que la pression atteigne 1 bar puis il est ensuite chauffé à 16O°. Les réactifs et les produits sont tous gazeux. La réaction est quantitative. A 20° sous la pression de 1 bar, le volume molaire des gaz est 24 L mol-1. Répondre par vrai ou faux en justifiant.
L'évolution au cours du temps de la quantité de matière de pentadioxyde de diazote présente dans le récipient est donnée par la courbe suivante: 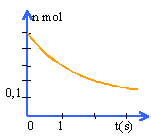
corrigé |
|
|
A partir de 0,5 mol de N2O5 il se formae 1 mol de NO2 et 0,25 mol de O2. Après réaction le récipient contient 1,25 mol de gaz. la vitessse d'une réaction augmente avec la température. Une vitesse de réaction est toujours positive. 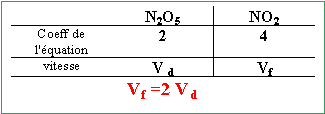
|
acide fort dosage |
On prépare 500 mL d'une solution d'acide bromhydrique en dissolvant du bromure d'hydrogène HBr dans de l'eau distilée. Le pH de la solution obtenue est 2. Lors d'un dosage d'un prélevement de 20 mL de solution par la soude à 0,02 mol/L, le volume équivalent est 10 mL. répondre par vrai ou faux en justifiant
corrigé |
|
|
H3O+ + HO- --> 2H2O A l'équivalence la quantité de matière d'acide (mol) est égale à la quantité de matière d'ion hydroxyde (mol). CAVA = CBVB CA=0,02*10 /20 =0,01 mol L-1. Nous constatons que pour la solution d'acide bromhydrique pH=-log c est bien vérifiée. Cet acide est, comme l'acide chlorhydrique un acide fort. Le pH à l'équivalence lors du dosage acide fort base fort est voisin de 7.
La zone de virage de l'indicateur coloré doit contenir le pH de la solution à l'équivalence. 0,01 mol d'acide par litre de solution.
Pour obtenir seulement 0,5 L de cette solution il a fallu dissoudre 0,005 mol de gaz HBr dans 0,5 L d'eau. Soit en volume : 0,005 * 25 = 0,125 L = 125 mL de gaz HBr.
|
mélange d'acides forts |
On mélange 100 mL d'acide chlorhydrique de pH=1 à 200 mL d'acide sulfurique de pH=2.
corrigé |
|
|
concentration de la solution d'acide chlorhydrique : 0,1 mol L-1. soit 0,01 mol d'ion hydronium dans 100 mL. concentration de la solution d'acide sulfurique : 0,01 mol L-1. soit 0,002 mol d'ion hydronium dans 200 mL. au total : 0,012 mol d'ion hydronium dans 300 mL [H3O+] = 0,012 / 0,3 = 0,04 mol L-1. pH=-log (0,04) = 1,4 .
|
constante de réaction dosage acide faible base forte solution tampon
|
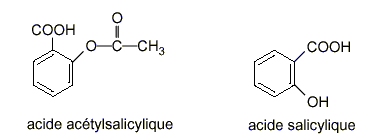
Étude de deux acides faibles : l'acide salicylique et l'acide acétylsalicylique et comparaison de leurs forces relatives par détermination des pKa des couples acide-base correspondants. Masse molaire de l’acide salicylique : 138 g / mol Masse molaire de l’acide acétylsalicylique : 180 g / mol Masses molaires atomiques en g / mol : Na = 23 : H=1 I – Étude d ’une solution d ’acide salicylique L’acide salicylique sera considéré comme un monoacide faible (on ne prend pas en compte l’acidité de la fonction phénol).
II – Étude d ’un mélange équimolaire d ’acide acétylsalicylique et d ’acétylsalicylate de sodium
III – Force relative de ces deux acides faibles À partir des résultats des expériences précédentes, comparer la force relative de ces 2 acides faibles.
corrigé
|
|
|
|
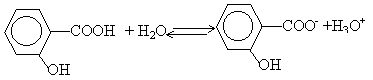
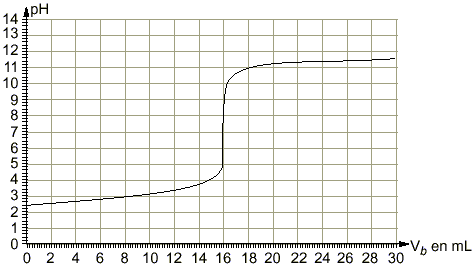
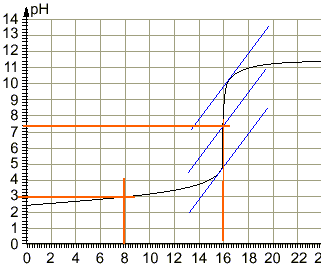
coordonnées du point d'équivalence :déterminées par la méthode des tangentes pH voisin de 7,4 et Vb=16 mL
le pH à la demi équivalence d'un dosage acide faible base forte est égal au pKa du couple acide base mis en jeu : pKa =3 équation bilan de la réaction de dosage : AH+HO- donne A- + H2O. H2O / HO- pKa=14 AH / A- pKa =3 on a mis en présence l'acide le plus fort d'un couple et la base la plus forte de l'autre couple : la constante de la réaction naturelle qui a lieu sera plus grande que 1. différence des pKa :11 constante de la réaction Kr =[A-] / ([AH] [HO-]) = 1011. (réaction totale) à l'équivalence acide base : Ca Va = Cb Vb Ca =0,015*16 / 25 = 0,0096 mol /L Quantité de matière d'acide acéthyle salicylique : 0,25 / 180 = 1,39 mmol
masse molaire de l'acéthylsalicylate de sodium : 180-1+23 =202 g/mol m2 /202 =1,39 10-3 m2 = 281 mg. La solution préparée contient en quantité égale l'acide faible A2H et sa base conjuguée A2- : c'est une solution tampon. Le pH mesuré est dans ces conditions égal au pKa du couple acide base mis en jeu. Le pH d'une solution tampon varie peu par ajout modéré d'acide fort ou de base forte. Le pH d'une solution tampon ne varie pas par dilution (ou ajout d'eau) car les concentrations de de l'acide et de la base conjuguée varie de la même manière. Les deux solutions d'acides faibles comparés ont la même concentration.
L'acide faible le plus fort est celui qui a le plus petit pKa. C'est à dire l'acide salicylique.
|
benzoate de sodium
|
Un bécher contient V = 100 cm3de solution de benzoate de sodium de concentration c = 0,01 mol L-1. (solution notée S2).On mesure le pH et on trouve pH = 8,1.
corrigé
|
|
|
|
C6 H5 COONa(s) donne Na + + C6 H5 COO - . Le pH d’une solution est défini par pH = -log [ H3 O +]. Le pH mesuré est >7, la solution est donc basique. C’est l’ion benzoate C6 H5 COO - qui a un caractère basique. Dans le ca d'une base forte (réaction totale avec l’eau) de concentration c = 0,01mol.L -1 , le pH vérifierait la relation pH = 14 + lg c ( relation valable pour des concentrations comprises entre 10 -5 et 10 -2 mol.L -1 ) soit pH= 12. la mesure indique pH = 8,1 : l’ion benzoate est une base faible ; la réaction avec l’eau n’est pas totale elle est limitée ce qui se traduit par l’équilibre chimique suivant :
pH = 5,5 si pH> pKa la base conjuguée prédomine
ici pKa = 4,2 donc c’est l’espèce ion benzoate C6 H5 COO - qui prédomine à pH=5,5
|
|
acide benzoïque |
On mesure le pH d'une solution S1 d'acide benzoïque de concentration c1 =0,01 mol.L -1 . Le pH-mètre indique 3,1.
corrigé |
|
|
|
Ici le pH est égal à 3,1 donc [H3O + ] = 10 -3,1 mol.L -1 ; [H3O + ] est inférieure à c donc la réaction de l'acide benzoïque avec l'eau est limitée. L'acide benzoïque est un acide faible.
L'acide le plus fort est l'acide benzoïque et la base la plus forte l'ion hydroxyde, d'où :
Kr = 10-4,2 / 10-14 = 10 9,8. La constante de réaction est très grande : la réaction peut être considérée comme totale.
|
|
solution tampon |
On réalise une solution S en mélangeant 20 mL de solution S1 et 20 mL de solution S2.
corrigé |
|
|
|
Les deux solutions S1 et S2 ont la même concentration et on en prélève le même volume ; l'acide benzoïque et l'ion benzoate ont donc même concentration dans le mélange. Or pH = pKa + lg [Base]/[Acide conjugué], doncpH = pKa= 4,2. Cette solution est une solution tampon:
|
estérification extraction rendement
|
Présentation L’acétate de menthyle (ou éthanoate de menthyle), dérivé du menthol, fait partie des espèces couramment utilisées dans le domaine de l’élaboration d’un parfum : sa présence dans un parfum amplifie la touche « florale », spécialement la note « rose » que développent les eaux de lavande commerciales. Dans la nature, on le trouve dans l’huile essentielle extraite de la menthe poivrée (Mentha piperata). Il est difficilement isolable car associé à de nombreuses autres espèces. On se propose d’étudier une préparation de ce composé en laboratoire à partir d’acide acétique (ou acide éthanoïque) et de menthol, lui-même obtenu par synthèse. – Caractéristiques des réactifs et produits :
I Préliminaires
corrigé
|
|||||||||||||||||||||||||
|
|
le menthol est un solide à la température ambiante de 20°. Une réaction d'esterification est lente, athermique et limitée par l'hydrolyse de l'ester. Le menthol est noté R-CHOH-R' R-CHOH-R'+ CH3CO2H en équilibre avec CH3-CO2-CHRR' + H2O menthol : 10 / 156 = 0,064 mol acide éthanoïque : 10*1,05 / 60 = 0,175 mol l'acide et l'alcool réagissent mole à mole, en conséquence le menthol est le réactif limitant et l'acide acétique est en excès. On obtiendrait dans le cas d'une réaction totale :0,064 mol d'ester soit : 0,064*198 = 12,67 g. Rôle du chauffage
Le chauffage élevant la température du mélange réactionnel augmente la vitesse de formation de l ’ester. Rôle du reflux On chauffe à reflux pour condenser les vapeurs formées et éviter ainsi les pertes de produits et de réactifs. Rôle de l ’acide sulfurique Il joue un rôle de catalyseur. Verrerie pour réaliser la séparation des deux phases
On utilise une ampoule à décanter et deux béchers pour récupérer les 2 phases (un pour chaque phase). Rôle du lavage de la phase organique Dans la phase organique il peut rester de l ’acide éthanoïque. L ’hydrogénocarbonate réagit avec l ’acide éthanoïque suivant : CH3CO2H + HCO3- donne CH3-CO2- + CO2 + H2O En lavant la phase organique par une solution d ’hydrogénocarbonate de sodium,on fait réagir l ’acide éthanoïque restant en le transformant en ion éthanoate qui part avec l ’eau de lavage (les ions éthanoate sont très solu- bles dans l ’eau et peu solubles dans la phase organique). Le gaz responsable de l ’effervescence est le dioxyde de carbone CO2 qui se dégage lors de la réaction entre l ’acide éthanoïque et l ’ion hydrogénocarbonate. Rendement de la synthèse
On obtient une masse d ’acétate de menthyle égale à 8,2 g Si la réaction avait totale on aurait obtenu une masse théorique d'ester de 12,627 g Le rendement de cette synthèse est : 8,2 / 12,67 *100 = 64,7%.
|
ester rendement facteurs cinétiques
|
masses atomiques molaires g /mol : H=1 ; C=12 ; O=16 Dans un erlenmeyer sec on introduit 12 g de propan-1-ol et 12 g d'acide éthanoïque. On porte ce mélange à 100 °C avec un dispositif de chauffage à reflux, dont la température est alors maintenue constante.
corrigé
|
|
|
|
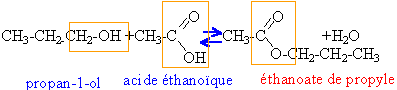
estérification : lente, athermique et limitée par l'hydrolyse de l'ester. chauffage : la température est un facteur cinétique, la vitesse de la réaction est beaucoup plus grande à 100°C qu'à 20°C à reflux : le réfrigérant à eau situé au dessus du ballon condense les vapeurs ; les gouttes liquides retombent dans le ballon: cela évite les pertes de matière. quantité de matière
acide éthanoïque : masse molaire 60 g/mol 12/60 = 0,2 mol alcool propan-1-ol : masse molaire 60 g/ mol 12 /60 = 0,2 mol donc mélange équimolaire. ester, éthanoate de propyle : masse molaire 102 g/mol 7,4 /60 =0,1233 mol d'acide restant 0,2-0,1233 = 0,0766 mol d'acide ayant réagi en conséquence 0,0766 mol d'ester formé. Une trempe, refroidissement brutal de 100°C à quelques degrés réalise un blocage cinétique.
Quantité d'ester formé au bout de 20 heures acide restant : 6,1/60 voisin 0,1 mol acide consommé : 0,2-0,1 =0,1 mol donc 0,1 mol d'ester, c'est à dire 50%. L'équilibre est atteint lorsqu'au départ d'un mélange équimolaire d'acide et d'alcool primaire , le rendement est 67%. Ici l'équilibre n'est pas encore atteint. vitesse moyenne =quantité d'ester formé divisée par la durée
0,07666 / 10 = 7,66 10-3 mol /heure 0,1/20 = 5 10-3 mol / heure Au bout de 20 heures la vitesse de formation de l'ester est plus faible car la concentration des réactifs a diminué. En utilisant un catalyseur (ion hydronium) on augmentera la vitesse de la réaction, sans pour autant modifier la composition du mélange à l'équilibre. Lorsque l'ester est le corps le plus volatil ( T ébullition la plus basse), on peut par distillation, enlever l'ester du mélange au fur et à mesure qu'il se forme. L'équilibre est alors déplacé dans le sens formation de l'ester. Ici cette méthode n'est pas applicable, ce n'est pas l'ester qui est le plus volatil.
autre méthodes : ajouter l'un des réactifs en excès remplacer l'acide par un chlorure d'acyle ou une anhydride d'acide. |
estérification hydrolyse
|
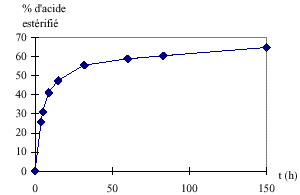
Le texte suivant décrit les expériences réalisées par BERTHELOT et PEAN DE SAINT-GILLES sur les réactions d’estérification et d’hydrolyse. “ Les expériences consistent en général à introduire les substances que l’on fait réagir dans des vases scellés, à les chauffer à une température déterminée pendant un temps plus ou moins long, à analyser les produits, enfin à calculer les résultats de l’analyse... Dans tous les cas de ce genre, le produit final se compose des mêmes corps... Mais ces corps sont dans des proportions telles qu’il suffit de déterminer exactement la masse d’un seul d’entre eux, à un moment quelconque des expériences, pour en déduire toutes les autres, pourvu que l’on connaisse les masses des matières primitivement mélangées. C’est évidemment l’acide qu’il faut déterminer, car l’acide se prête à des dosages plus rapides et plus précis qu’aucun autre composant... On transvase le produit final dans un vase à fond plat, on ajoute quelques gouttes de teinture de tournesol, et l’on verse l’eau de baryte (solution d’hydroxyde de baryum : Ba 2+ + 2 OH - ) avec une burette graduée jusqu'à ce que la teinte rose ou violacée du tournesol ait viré au bleu franc... Si l’on élimine l’eau, la réaction d’un acide sur un alcool, à quantités de matière égales, peut atteindre un rendement de 100 %.”
La réaction d’estérification
Pourcentage d’acide estérifié
Etude des vitesses de réaction
corrigé
|
|||||||||
|
|
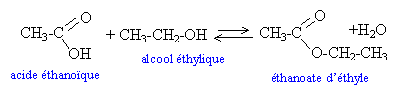
Il parle de l’ensemble des espèces chimiques présentes à l’équilibre. L’acide éthanoïque et l’éthanol non estérifiés ainsi que l’éthanoate d’éthyle et l’eau formés. n(acide éthanoïque) = n0 - x n(éthanol) = n0 - x n(ester) = x n(eau) = x dosage :
Erlenmeyer contenant le mélange et la teinture de tournesol Burette graduée contenant l’eau de baryte CH3COOH + HO- donne CH3COO- + H2O A l’équivalence la quantité d’acide dosé est égale à la quantité d’ions OH- versée n(acide dosé) = n(OH-) Puisque Ba(OH)2 donne Ba2+ ++ 2 OH- alors n(OH-) = 2CV et n(acide dosé) = 2CV n(acide estérifié) = n0 - 2CV
vitesse :
La vitesse de formation de l’ester diminue au cours du temps car la quantité de réactifs diminue au cours du temps. Le temps mis pour atteindre un pourcentage donné d’acide estérifié est plus grand à température ambiante qu’à 100°C. On peut en conclure que la température est un facteur cinétique. Une augmentation de température permet d’atteindre plus rapidement l’état d’équilibre. On pourrait ajouter un catalyseur. L’acide sulfurique par exemple. Lorsqu’on élimine l’eau, il n’y a plus de réaction d’hydrolyse et donc la réaction d’estérification n’est plus limitée. Le rendement peut alors atteindre 100%. |
|
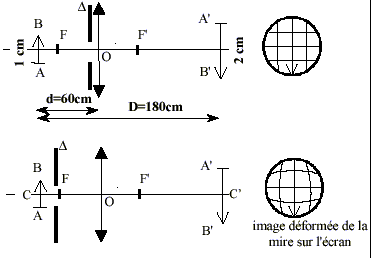
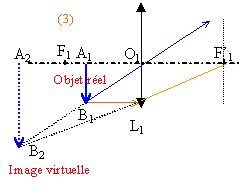
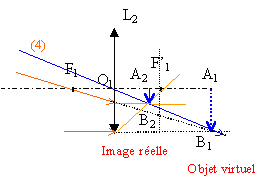
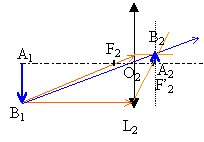
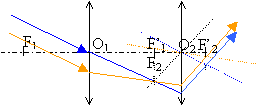
Le but de cet exercice est d'illustrer les difficultés à obtenir une image de bonne qualité. Pour cela, on dispose d’extraits d’un compte-rendu de travaux pratiques de deux élèves. Leurs formulations et leurs représentations ne sont pas toujours rigoureuses. On se propose de commenter leurs résultats et d’approfondir leurs conclusions. a) Expérience
corrigé |
||||
|
|
grandissement : mesure algébrique de l'image divisée par la mesure algébrique de l'objet. D'après les notations c'est aussi p' / p. d'après les dimensions de l'objet et de l'image le grandissement est -2 (le signe moins traduit une image inversée par rapport à l'objet) p= -0,6 m et p'= 1,2 m : on confirme la valeur -2 du grandissement. placer le diaphragme contre la lentille (position fixe) conditions de Gauss.
choisir des diaphragmes de différentes ouvertures (diamètres différents) écran fixe déplacer l'objet afin de déterminer les positions extrèmes donnant une image nette sur l'écran. faire de même pour chaque diaphragme.
|
|||
irisation de l'image |
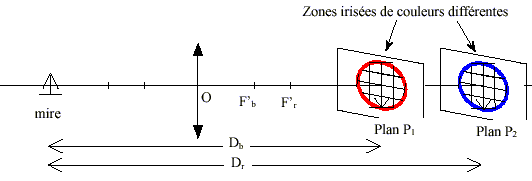
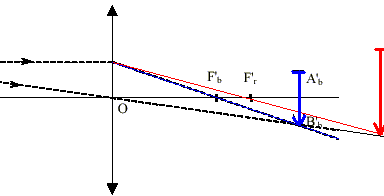
L’image d’un objet en lumière blanche peut être colorée sur son contour. Ceci est dû à la décomposition de la lumière : on dit que l’image est irisée. détermination des distances focales en lumière bleue et en lumière rouge : On a réalisé l’image de la mire sur le mur de la classe suffisamment éloigné de la lentille pour être considéré à l’infini. On a trouvé ainsi les distances focales f'b= 39,0 cm en lumière bleue et f'r= 40,5 cm en lumière rouge. On a placé la mire à d = 60,0 cm de la lentille. On a déterminé les positions où devraient se former les images en lumière bleue et en lumière rouge. On a trouvé en lumière bleue que l’image se forme dans un plan P1 situé à la distance Db = 161,4 cm et en lumière rouge dans un plan P2 à Dr = 184,6 cm (voir schéma ci-dessous). Observation en lumière blanche : En déplaçant l’écran, on a obtenu une image tantôt irisée en rouge, tantôt irisée en bleu comme montré sur le schéma ci-dessous.
La figure n’est pas à l'échelle. Les foyers et images en lumière bleue sont repérés par la lettre b en indice et ceux en lumière rouge par la lettre r en indice. 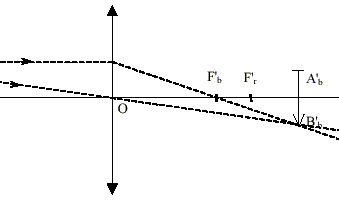
corrigé |
|||
|
|
Lorsque l'image se forme à l'infini, l'objet est au foyer principal objet. Il suffit alors de mesurer la distance lentille objet pour trouver la distance focale de la lentille.
|
|||
|
Un photocopieur permet la reproduction d’un document original de surface S. Le système optique comporte entre autre un objectif constitué de plusieurs lentilles. L’image de l’ original est recueillie sur un tambour photosensible. Si g est le grandissement du système optique, la surface S’ de la photocopie est : S' = g²S. L’objectif du système optique est modélisé à l’aide du matériel d’optique d’un lycée. On place sur un banc optique :
L’axe optique principal est orienté dans le sens de propagation de la lumière. O est le centre optique de la lentille, A un point objet placé sur l’axe principal, A’ le point image de A et F’ le foyer principal image. L’objectif est assimilé à une lentille mince convergente L de centre optique O et de distance focale f '.
corrigé
|
|
|
|
Une lentille convergente donne d'un objet réel une image réelle renversée. grandissement g = -1
|
agrandissement d'un document |
Dans ce cas l’objectif du système optique est modélisé en utilisant deux lentilles : une lentille convergente L1 de vergence C1=5,0 d ; une lentille divergente L2 de vergence C2= -3.0d . Le centre optique O1 de la lentille L1 est placée à 60,0 cm de A ; la lentille L1 donne de AB l’image A1B1. La lentille L2 est placée à droite de L1. Son centre optique O2 est tel que mesure algébrique de O1O2 =8,6 cm. L2 donne de A1B1 l’image définitive A’B’ sur l’écran.
corrigé |
|
|
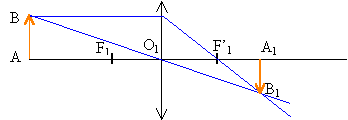
à partir de la formule de conjugaison on trouve mesure algébrique de O1A1=0,3 m grandissement g1 =0,3 / (-0,6 ) = -0,5
mesure algébrique de O2A1 = -0,086+0,3 =0,214 m mesure algébrique de O2A' =1,286-0,6-0,086 = 0,6 m grandissement g2 = 0,6 / 0,214 = 2,8 grandissement du système g = g1 g2 = -0,5*2,8 = -1,4 la surface de la photocopie est proportionnelle à g²soit à 1,4² voisin de 2
|
réduction d'un document |
Dans ce cas, pour modéliser l’objectif, on permute les deux lentilles précédentes L1 et L2. La lentille L2 donne de AB l’image A2B2. La lentille L1 donne de A2B2 l’image définitive A’B’ sur l’écran.
corrigé |
|
|
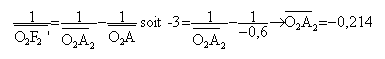
grandissement g1 =-0,214 / (-0,6 ) = 0,36 mesure algébrique de O2A1 = -0,086-0,214 = -0,3 m mesure algébrique de O2A' =1,286-0,6-0,086 = 0,6 m grandissement g2 = 0,6 / (-0,3 )= -2 grandissement du système g = g1 g2 = 0,36*(-2) = -0,72 la surface de la photocopie est proportionnelle à g²soit à 0,72² voisin de 0,51
|
oeil
|
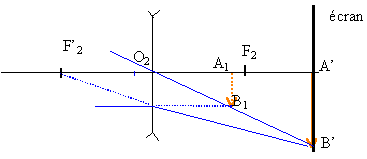
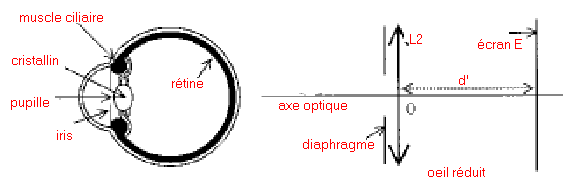
Description de l'expérience On tient une lentille L1 de vergeure C1 = +8 d à bout de bras et on regarde à travers cette lentille un objet AB trés lointain (considéré comme à l'infini) : l'image de cet objet est vue nette et renversée si le bras est bien tendu. On rapproche alors la lentille de l'œil tout en regardant ce même objet à travers la lentille : l'image devient progressivement très floue, jusqu'à disparaître. puis lorsque la lentille est très proche de l'œil, elle réapparaît presque nette mais droite. On cherche dans cet exercice à interpréter ces observations en modélisant l'œil et en étudiant le système de deux lentilles convergentes formé par la lentille de vergence 8 d et l'œil. Première partie: modélisation de l'œil On peut donner de l'œil un modèle simplifié appelé " œil réduit" :
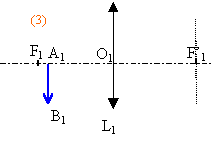
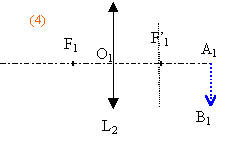
La vergence C2 de L2 est variable (caractéristique due à la déformation possible du cristallin).Un objet n'est vu nettement par l'œil que si son image se forme sur la rétine située à une distance d' fixe du cristallin. L'œil normal donne d'un objet à l'infini une image nette sur la rétine sans avoir à accommoder. On dit que l'œil est au repos. Sa vergence est alors minimale et vaut 60 d. Quand l'œil normal regarde un objet rapproché, le cristallin se déforme : on dit que l'œil accommode. De même, dans l'œil réduit la vergence C2 de la lentille L2 augmente. 1- Calculer, en centimètres, la valeur de la distance d' entre la lentille L2 et l'écran (équivalente à la distance séparant le cristallin de la rétine). 2 -Calculer la vergence maximale de L2 sachant que la distance minimale de vision distincte pour l'œil normal est de 25 cm. Deuxième partie : système ( lentille L1 + œil ) correspondant à l'expérience la lentille L1 de vergence C1 = +8 d donne de l'objet AB à l'infini une image A1B1. Cette image sert d'objet pour la lentille L2 de vergence C2 qui en donne une image A2B2. La vergence C2 est variable comme il a été rappelé précédemment. On rappelle que la perception visuelle est inversée par rapport à A2B2 (une image finale A2B2 orientée vers le bas correspond à la vision d'un objet orienté vers le haut). 1 - Préciser la position de l'image A1B1 donnée par L1 de l'objet AB à l'infini. Construire cette image sur le schéma 1 de l'annexe à rendre avec la copie. (ci-dessous) 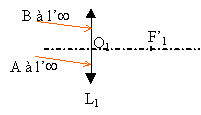 2 - On considère les différentes positions de cette image A1B1 par rapport à l'œil lorsque l'on rapproche L1 de celui-ci supposé au repos. a)Sur les schémas 2, 3, 4 ci-dessous, construire l'image A2B2 que donne la lentille L2 de l'objet A1B1. b)Indiquer sur chaque schéma la nature (réelle ou virtuelle) de l'objet A1B1 et de l'image A2B2 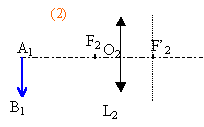
3 - a) En s'aidant du schéma 2, montrer que l'accommodation permet d'avoir une image nette. b) À quelle distance minimale de l'œil doit se trouver A1B1 pour que l'image se forme sur la rétine ? c) Quelle doit être alors la longueur minimale du bras tendu ? 4- A l'aide du schéma 4, interpréter la fin de la description de l'expérience : " puis lorsque la lentille est très proche de l'œil, elle (l'image) réapparaît presque nette mais droite ".
corrigé
|
|
|
|
distance focale : 1/60 = 0,0166 m = 1,66 cm. L'objet est maintant à 25 cm devant l'oeil et l'image se forme toujours sur la rétine mesure algébrique de OA : -0,25 m mesure algébrique de OA' : 0,01666 m nouvelle distance focale : 1/f ' =1 / 0,0166 + 1/ 0,25 = 60+4 =64 d'où f ' = 1/64 et la vergence maximale vaut C=64 d. 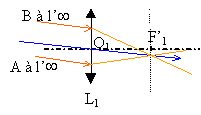
l'image A1B1 se forme dans le plan focal image passant en F'1. 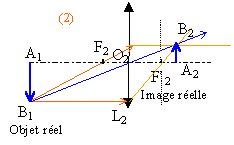
En accomodant la distance focale de l'oeil diminue, l'image nette est sur la rétine et l'objet A1B1 se trouve à la distance minimale de vision distincte soit 25 cm devant l'oeil.
A1B1 est au foyer image de L1. ( AB à l'infini). la longueur du bras tendu est : 1/8 +0,25 = 37,5 cm
On se trouve dans le cas de figure n°4 :
objet AB à l'infini donc A1B1 au foyer image de L1 . A1B1 à 1/8 = 0,125 m = 12,5 cm à gauche de L1 et la profondeur de l'oeil est de 1,66 cm. L'image est sur la rétine de même sens que A1B1. La lentille L1 est donc à 12,5-1,66 = 10,84 cm devant l'oeil.
|
image grossissement principe du zoom
|
rappels : pouvoir séparateur de l'oeil : environ une minute d'angle soit 3 10-4 rad. grossissement d'un instrument d'optique G = a' / a. a': angle sous lequel on voit l'image donnée par l'instrument a : angle sous lequel on voit l'objet à l'oeil nu. I Lunette astronomique : On se propose de simuler une lunette astronomique. Un élève construit une lunette avec 2 lentilles convergentes L1 (objectif) de vergence C1=2d et L2 (oculaire) de vergence C1=8d. La lunette est afocale : le foyer principal image de l'objectif coïncide avec le foyer principal objet de l'oculaire.
II Lunette terrestre : Une lunette terrestre est constituée de la même manière qu'une lunette astronomique. L'oeil de l'observateur est placé au foyer de l'oculaire.
corrigé
|
|
|
|
distance focale = inverse de la vergence f'1 =1/2 =0,5 m et f'2 = 1/8 = 0,125 m
L'image d'un objet à l'infini est dans le plan focal image de la lentille L1. L'image d'un objet réel situé à gauche de F1, donnée par une lentille convergente, est réelle et renversée. Ce n'est pas génant dans le cas d'une lunette astronomique, car les objets observés sont sphériques. L'image intermédiaire A1B1 est un objet pour la lentille L2. Cet objet étant dans le plan focal objet de L2, l'image définitive sera rejetée à l'infini.
triangle O1A1B1 : tan a =A1B1 / f1'. triangle O2A1B1 : tan a' =A1B1 / f2'. si les angles sont petits on peut confondre les tangentes avec les angles exprimés en radians. d'où G = a' /a = f1'/ f2'. Le grossissement est d'autant plus grand que f1' est grand ( objectif peu convergent) et que f2' est petit (oculaire très convergent). On peut redresser l'image avec un jeu de miroirs inclinés à 45°.
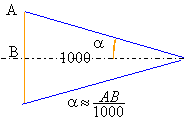
angle sous lequel la statue est vue à l'oeil nu : tan a =2 /10000 =2 10-4 . a =2 10-4 rad inférieur au pouvoir séparateur de l'oeil. Le grossissement est multiplié par 20 si l'angle sous lequel est vu l'objet est divisé par 20. Ce qui revient à diviser par 20 la distance observateur objet. Distance focale de l'objectif : f1' = G*f2' = 0,02*20 = 0,4 m. Le principe du zoom est basé sur la modification de la distance focale d'un ensemble de lentilles jouant le rôle d'objectif. Le grossissement augmente proportionnellement à la distance focale de l'objectif.
Le grossissement est inversement proportionnel à l'angle a. Si le grossissement augmente, l'angle a diminue; AB est plus petit et le champ est plus faible
|
modulation démodulation |
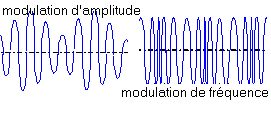
Un élève a réalisé, au cours d'une séance de TP, un récepteur radio réglé sur 164 kHz permettant l'écoute de France inter grandes ondes. La mise en oeuvre des étages suivants a été réalisée : - Gràce à un oscilloscope à mémoire on a enregistré sur la voie A, le signal reçu par le capteur et sur la voie B le signal électrique à la sortie du démodulateur.  modulation d'amplitude et de fréquence :
Le capteur d'ondes radioélectriques: il est équivalent à une bobine idéale associée avec un condensateur en série. Pour une valeur donnée de l'inductance L, ce circuit permet une bonne écoute de France inter. 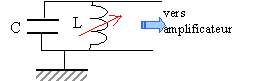
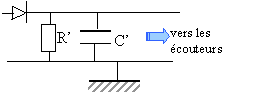
Le démodulateur:il est constitué d'une diode, d'un conducteur ohmique R' et d'un condensateur de capacité C'.
corrigé
|
|
|
|
La fréquence de la porteuse est supérieure à 100kHz; la fréquence du signal modulant à transporter est comprise entre 100 Hz et 15 KHz modulation d'amplitude : l'amplitude de la porteuse varie, est modulé par le signal basse fréquence. modulation de fréquences: la fréquence de la porteuse varie, est modulée par le signal modulant .
On a enregistré France inter en modulation d'amplitude. voie A : porteuse modulée voie B : signal démodulé il faut accorder le récepteur sur la fréquence de 164 kHz.
la fréquence propre de ce circuit est 164 000 Hz 164 000 = 1 / (2*3,14 racine carrée (L* 0,47 10-9 ) ) L*0,47 10-9 = 1 / (164 000*6,28 )² = 9,42 10-13. L = 2 mH. période de la porteuse : 1 /164 000 = 6,1 ms. la largeur de l'écran de l'oscilloscope correspond à 10 divisions 6 ,1 m s <--> 10 div sensibilité retenue : 1 m s / div. longueur d'onde (m) = célérité (m/s) / fréquence (Hz) = 3 108 / 164 000 = 1829 m. capacité (F) = charge (coulomb) / tension (volt) homogène à : [C] [V]-1.
charge électrique (C) = intensité (A) fois temps (s) homogène à : [A] [s]-1. capacité homogène à : [A] [s]-1V]-1. résistance = tension / intensité soit homogène à : [V] [A]-1. RC homogène à [s] périodes Tp = 6 10-6 s. Ts = 1/1000 = 10-3 s 10-3 > R'C' >>6 10-6 avec R' = 15 000 W. 10-3 / 15 000> C' >>6 10-6/ 15000 66 10-9 / 15 000> C' >>0,4 10-9. 66 nF > C' >> 0,4 nF donc 10 nF à retenir.
|
Ecrire l'équation-bilan de la réaction donnant le précipité blanc. Déterminer la concentration massique volumique des ions chlorure dans l'eau n° 3. corrigé |
|
|
|
Ag+ + Cl- donne AgCl solide blanc. A l'équivalence : Quantité de matière d'ion Ag+ = Quantité de matière d'ion Cl-. 0,0133*2,5 10-2= 0,05*[Cl-] [Cl-] = 6,65 10-3 mol L-1. concentration massique : 35,5*6,65 10-3 = 236 mg L-1.
|
|
Dans un ballon bicol de 250 mL on introduit environ 20 mL de soude à 1 mol/L, puis V = 2,0 mL de benzaldéhyde et, enfin, quelques grains de pierre ponce. On adapte un refrigérant à reflux et une ampoule de coulée, dans laquelle on verse V1 = 60 mL de solution de permanganate de potassium à C=0,25 mol/L À l'aide d'un chauffe-ballon placé sur un plateau à crémaillère, on porte le mélange réactionnel à ébullition douce, puis on ajoute goutte à goutte la solution oxydante. Aux premières gouttes versées, la solution est verte, puis un précipité marron de dioxyde de manganèse Mn02 se forme. En fin d' addition, on laisse bouillir pendant environ 5 minutes. Pour réduire le permanganate introduit en excès, on ajoute quelques gouttes d'éthanol jusqu'à disparition de la teinte violacée de la phase liquide. On retire le ballon du chauffe-ballon tout en maintenant le reflux. Après refroidissement, on filtre le mélange sur un filtre Büchner : le filtrat est limpide. On le verse alors dans un erlenmeyer contenant 10 mL d'acide chlorhydrique à 5 mol/L L'acide benzoïque précipite ; on place l'erlenmeyer dans un bain eau-glace pour favoriser la précipitation. On filtre alors le mélange sur Büchner; le solide obtenu est rincé, puis séché à l'étuve. Une fois sec, il est pesé; on trouve m = 1,94 g. Données : Masse volumique du benzaldéhyde : 1,04 g/mL. Solubilité dans l'eau de l'acide benzoïque : 2,4 g/L à 20 °C, et 68 g/L à 95 °C ; du benzoate de sodium: 400 g/L à 20 °C. Potentiels standard rédox à 25 °C E°(MnO4- / Mn02) -1,69 V ; E°(C6H5COOH / C6H5CHO) = 0 V ; E°(CH3COOH / CH3CH2OH) = 0,05 V. E°( MnO4- / MnO42- ): 0,56 V
corrigé
|
|||||||||
3 fois{ C6H5 CHO + 3 HO- = C6H5 COO- + 2H2O + 2e- } ( oxydation) 2MnO4- + 3 C6H5 CHO + HO- --> 2MnO2 + 3C6H5 COO- + 2H2O Quantité de matière initiale des réactifs :
C6H5 CHO : masse molaire = 7*12+6+16 = 106 g/mol masse (g) = volume (mL) fois masse volumique (g/mL) = 2* 1,04 = 2,08 g puis 2,08 / 106 = 19,6 mmol ion permanganate : concentration (mol/L) * volume (L) = 0,25 *0,06 = 15 mmol d'après les coefficients de l'équation bilan :
or on dispose de 15 mmol d'ion permanganate ( soit 2 mmol en excès). réaction initiale :
2fois{ MnO4- + e- = MnO42- }( réduction) C6H5 CHO + 3 HO- = C6H5 COO- + 2H2O + 2e- ( oxydation) 2 MnO4- +C6H5 CHO + 3 HO--->2 MnO42- +C6H5 COO- + 2H2O réduction excès ion permanganate :
4 fois{ MnO4- + 3e- + 2H2O = MnO2 + 4 HO- }( réduction) 3 fois{ CH3CH2OH + 5 HO- = CH3COO- + 4e- + 4H2O } ( oxydation) 4 MnO4- + 3 CH3CH2OH --> 4 MnO2 + 3CH3COO- + 4 H2O +HO- l'ion acétate (éthanoate ) est une base : elle va réagir avec l'acide chlorhydrique ajouté pour donner l'acide éthanoïque , soluble dans l'eau alors que l'acide benzoïque formé est quasiment insoluble dans l'eau à 20°. cet ion acétate n'est pas génant d'autant plus qu'il n' est ni oxydant ni réducteur dans ces conditions. acide benzoïque : rendement :
en présence d'acide chlorhydrique l'ion benzoate, soluble dans l'eau conduit à l'acide benzoïque C6H5 COO- + H3O+ -->C6H5 COOH + H2O réaction acide base. l'acide benzoïque est d'autant moins soluble dans l'eau que la température est plus basse. rendement = masse réelle / masse théorique calculée à partir de 19,6 mmol de benzaldehyde on peut théoriquement obtenir 19,6 mmol d'acide benzoïque masse molaire C6H5 COOH : 7*12+6+32 = 122 g/mol masse théorique : 122 *0,0196 = 2,39 g rendement = 1,94 / 2,39 = 0,81. (81%) chromatographie:
Une chromatographie sur couche mince permet d'identifier et de séparer les constituants d'un mélange en jouant sur la différence de solubilité d'une substance entre un support fixe et une phase mobile ( l'éluant). le révélateur ( ici rayons UV) permet de rendre visible des taches initialement incolores. L'acide benzoïque et le benzaldehyde possédant un noyau benzénique peuvent absorbés les rayons UV. Sur la plaque CCM sensible aux UV on observera donc des taches sombres ( en éclairant avec une lampe UV) aux endroits des taches.
|
Chers élèves voici le site dont tout un chacun recherchait ! Vous l'avait beaucoups recherché? Alors des élèves du pays l'ont realisé pour vous ! vous pouvez aussi proposer des exercices en ajoutant des commentaires salut et bonne visite |
Vous pouvez donner votre opinion sur des exercices enfin d'y apporter des solutions. |
Vous pouvez aussi proposer des exercices pour l'enrechissement du site et pour nous permettre de bien satisfaire les demandes et besoins des élèves. |
Ce site est le premier site d'exercices totalement gratuit au senegal . |
Il a été créé en 2008 par des élèves en classe de 1ère au lycée des parcelles assainies(LPA). |